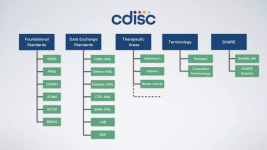
CDISC(Clinical Data Interchange Standards Consortium)临床数据交换标准协会就如何收集数据、收集什么类型的数据以及如何将数据提交给负责审批新药的机构建立起了一套标准。涉及临床研究电子数据的获取、交换、...
”CDISC“ 的搜索结果
数据库标准化之CDISC
标签: 数据库
CDISC是临床数据交换标准协会(Clinical Data Interchange Standards Consortium)的缩写,是一个致力于制定和推广临床研究数据标准的非营利性组织。CDISC的目标是通过制定和推广数据标准,促进医学研究和相关医疗...
cdisc-standard A collection of CDISC related standards in English and Chinese. 标准名称 英文版本 中文版本 CDASH std v1.1 征求意见稿20150201 SDTM v1.2 征求意见稿20150201 SDTMIG v3.1.2 征求意见稿...
CDISC SDTMIG V 3.4
----------------------- CDISC数据库注释全文共10页,当前为第1页。 CDISC数据库注释全文共10页,当前为第2页。 CDISC数据库注释全文共10页,当前为第3页。 CDISC数据库注释全文共10页,当前为第4页。 CDISC数据库...
临床试验数据的标准化之路,究竟还有多远?
CDISC 简单介绍
标签: 数据分析
CDISC,中文名称:临床数据交换标准协会(CDISC - the Clinical Data Interchange Standards Consortium)
rdf.cdisc.org FDA / PhUSE语义技术项目 代表RDF中的CDISC基础标准 介绍 FDA / PhUSE语义技术项目研究了正式的语义标准如何支持从协议到提交的临床和非临床试验数据生命周期。 在该项目中,几个团队从事专门的任务...
该工具可用于将基于 IBM SPSS Statistics 的数据集合转换为用于定义和交换临床试验的数据标准:CDISC ODM(操作数据模型)。 可能的用例: - 项目资金耗尽,科学数据收集应在免费可用/开源数据捕获系统中进行 - 可靠...
“智能提交数据集查看器”是“智能数据集-XML 查看器”(已停产)的后继产品,允许以现代 CDISC 数据集-XML 标准格式检查 CDISC SDTM、SEND 和 ADaM 提交文件。 “智能提交数据集查看器”的许多功能远远超出了监管...
R4DSXML是R包,用于导入CDISC数据集XML和Define-XML作为R数据帧。 特征 支持CDISC Dataset-XML 1.0,Define-XML 2.0, :NEW_button: 定义XML 2.1和分析结果元数据1.0。 从Dataset-XML到R数据帧的隐蔽。 从Define-...
EZConvert 的工作原理是使用提供的 Define-XML 为提供的每个 XML 数据集生成 SAS 输入语句。 用户指定放置 .SAS 程序的文件夹。 用户还可以指定是否应生成 SAS 数据集或 SAS Xport 文件。 如果在属性文件中指定了 ...
规范药厂提供的数据,例如实验结果图表,原始数据和中间步骤数据集,规范有效性判断指标,方便核对待审药物临床实验的数据变量和数值意义,确保避免多次反复核对. 优点:针对每期实验的过程所指定的标准 ...
获取施加于受试者身上的干预措施(伴随有实际的或预期的生理效应),包括研究性治疗、伴发疾病的治疗和其他治疗或干预等。这些措施包括,基于研究方案确定的(例如,暴露于某一研究药物),或与研究评估阶段同时发生...
CDISC:我正在收集有关CDISC的信息
CDISC查询使用 SPARQL 搜索 CDISC 术语的 Shiny Web 应用程序。功能这个 Shiny Web 应用程序可用于从 CDISC 标准和 CDISC 术语以及 OpenCDISC config.xml 的验证规则中搜索关键字。要求您必须设置一个 SPARQL 端点来...
本AdaMIG (v3.2)来自CDISC官网以下链接: https://www.cdisc.org/standards/foundational/adam/adam-implementation-guide-v1-2-release-package Analysis Data Model Implementation Guide Version 1.2 ...
总结SDTM IG3.3版本相对于IG3.2版本的变化
2 Fundamentals of the SDTM SDTM基础 2.1 Observations and Variables 观测(数据)和变量 The V3.x Submission Data Standards are based on the SDTM’s general framework for organizing clinical trials ...
CDISC--SDTM--简述SE
标签: sas
SE 描述受试者接受真实的临床试验流程(ELEMENT)以及该流程所处的每个时期(EPOCH),每条record包含每个流程的开始(sestdtc)和结束(seendtc)日期时间。 通常根据protocol里的Schema或者Schedule of ...
本AdaMIG (v1.2)来自CDISC官网以下链接: https://www.cdisc.org/standards/foundational/adam/adam-implementation-guide-v1-2-release-package 第3章(上) (第3章拆分为上下2部分,因字数太多,被限制发表。...
This document comprises the CDISC Version 3.2 (V3.2) Study Data Tabulation Model Implementation Guide for Human Clinical Trials (SDTMIG), which has been prepared by the Submissions Data Standards (SDS...
CDISC递交数据--SDTM Dataset Metadata之Origin
本AdaMIG (v3.2)来自CDISC官网以下链接: https://www.cdisc.org/standards/foundational/adam/adam-implementation-guide-v1-2-release-package 2 Fundamentals of the ADaM Standard ADaM标准的基础 2.1 ...
本AdaMIG (v1.2)来自CDISC官网以下链接: https://www.cdisc.org/standards/foundational/adam/adam-implementation-guide-v1-2-release-package 本章为最终章。 5 Appendices附录 Appendix A: Abbreviations ...
本AdaMIG (v1.2)来自CDISC官网以下链接: https://www.cdisc.org/standards/foundational/adam/adam-implementation-guide-v1-2-release-package 第4章(下) 4.5Identification of Records Used for Analysis ...
本AdaMIG (v1.2)来自CDISC官网以下链接: https://www.cdisc.org/standards/foundational/adam/adam-implementation-guide-v1-2-release-package 第3章(下) (第3章拆分为上下2部分,因字数太多,被限制发表。...
上篇文章末尾的图片,此篇文章会一一介绍。 CRF All the variables mapped from CRF fields should have origin of CRF. This includes variables with Multiple rule and text greater than 200 characters ...
推荐文章
- com.netflix.discovery.shared.transport.TransportException: Cannot execute request on any known serve-程序员宅基地
- PAT乙级练习题1010 一元多项式求导_pat 乙级 1010-程序员宅基地
- You can also run `php --ini` inside terminal to see which files are used by PH P in CLI mode_you can also run `php --ini` in a terminal to see -程序员宅基地
- 对UDP校验和的理解_udp 数据包 校验和 checksum=0-程序员宅基地
- 递归遍历文件夹,以c:/windows为例-程序员宅基地
- git 本地与远程的链接_git如何本地和网页链接-程序员宅基地
- ArrayList与HashMap遍历删除元素,HashMap与ArrayList的clone体修改之间影响_在arraylist和hashmap遍历的同时删除元素,可能会导致一些问题发生-程序员宅基地
- Chapter2-软件构造过程和生命周期_iterative and agile systems development lifecycle -程序员宅基地
- 4.6 浮动定位方式float_c语言中float的左右浮动属性示例-程序员宅基地
- OSS上传【下载乱码问题】_阿里云oss文件名乱码-程序员宅基地